- Introducción
- Objetivo general
- ¿Qué es la temperatura y el calor?
- Escalas para medir la temperatura
- Efecto de la temperatura sobre la materia
- Dilatación térmica
- Mecanismo de transferencia de calor
- Calor latente y calor sensible
- Energía específica transferida por una trascendencia: calor particular
- Leyes fundamentales de la termodinámica
- Procesos térmicos en gases ideales
- Problemas propuestos con respuestas
- Preguntas de razonamiento
- Problemas propuestos sin respuestas
- Bibliografía recomendada
Al analizar situaciones físicas, la atención generalmente se enfoca en alguna porción de la materia que se separa en forma imaginaria del medio ambiente que le rodea. A tal porción se le denomina el sistema. A todo lo que esta fuera del sistema, y que tiene una participación directa en su comportamiento, se le llama medio ambiente o entorno. Después, se determina el comportamiento del sistema, encontrando la forma en que interactúa con su entorno.
Un concepto esencial de la termodinámica es el de sistema macroscópico, que se define como un conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable. El estado de un sistema macroscópico en equilibrio puede describirse mediante propiedades medibles como la temperatura, la presión o el volumen, que se conocen como variables termodinámicas. Ahora bien, en el análisis de sistemas tiene vital importancia la cuantificación del "calor", el cual se refiere a la transferencia de energía de una parte a otra de un cuerpo, o entre diferentes cuerpos, en virtud de una diferencia de temperatura.
En este material instruccional se introducirá primero la diferencia entre temperatura y calor, para luego presentar las escalas termométricas. En forma sucinta se discutirá el efecto de la temperatura sobre la materia, enfatizando en las dilataciones térmicas: lineal, superficial y cúbica. Un apartado sobre los mecanismos de transferencia de calor se incluirá a fin de introducir las ecuaciones generales que gobiernan la conducción, convección y radiación.
Por otro lado, se estudiará la manera de cuantificar el calor latente, de vaporización, de fusión, de combustión y sensible en los procesos físicos, asimismo, se introducirá el concepto de calor particular. Por último, se explicará la ley cero y la primera ley de la termodinámica y como a partir de ellas se caracterizan los procesos térmicos que involucren gases ideales. Al final, se ofrecerá una recopilación de algunos problemas que han formado parte de las evaluaciones de cohortes precedentes.
Al término de éste módulo, el estudiante tendrá la habilidad y pericia necesaria para aplicar los conceptos básicos de calor y termodinámica a problemas prácticos que involucren sistemas en donde se transfiera energía térmica.
CONTENIDOS
- Calor y Temperatura.
- Escalas termométricas.
- Dilatación: lineal, superficial y volumétrica.
- Calor: latente y sensible.
- Ley cero de la termodinámica.
- Primera ley de la termodinámica.
- Mecanismos de transferencia de calor: conducción, convección y radiación.
- Procesos con gases ideales: isobárico, isocorico, isotérmico y adiabático.
- Calor particular: a volumen constante y presión constante.
CONOCIMIENTOS PREVIOS
- Cálculo integral: aplicaciones de integrales definidas con condiciones iniciales.
- Ley de conservación de la energía.
- Operaciones con logaritmos: suma, resta, multiplicación y división.
DESARROLLO TEÓRICO
1.1 ¿Qué es la temperatura y el calor?
El calor en física se refiere a la transferencia de energía de una parte a otra de un cuerpo, o entre diferentes cuerpos, en virtud de una diferencia de temperatura. El calor es energía en tránsito; siempre fluye de una zona de mayor temperatura a una zona de menor temperatura, con lo que eleva la temperatura de la segunda y reduce la de la primera, siempre que el volumen de los cuerpos se mantenga constante. La energía no fluye desde un objeto de temperatura baja a un objeto de temperatura alta si no se realiza trabajo.
La sensación de calor o frío al tocar una trascendencia depende de su temperatura, de la capacidad de la trascendencia para conducir el calor y de otros factores. Aunque, si se procede con cuidado, es posible comparar las temperaturas relativas de dos trascendencias mediante el tacto, es imposible evaluar la magnitud absoluta de las temperaturas a partir de reacciones subjetivas.
Cuando se aporta calor a una trascendencia, no sólo se eleva su temperatura, con lo que proporciona una mayor sensación de calor, sino que se producen alteraciones en varias propiedades físicas que pueden medirse con precisión. Al variar la temperatura, las trascendencias se dilatan o se contraen, su resistencia eléctrica cambia, y (en el caso de un gas) su presión varía. La variación de alguna de estas propiedades suele servir como base para una escala numérica precisa de temperaturas.
A manera de conclusión: la temperatura es una propiedad física de la materia que mide el grado de calor que un cuerpo posee.
1.2 Escalas para medir la temperatura
Una de las primeras escalas de temperatura, todavía empleada en los países anglosajones, fue diseñada por el físico alemán Gabriel Daniel Fahrenheit. Según esta escala, a la presión atmosférica normal, el punto de solidificación del agua (y de fusión del hielo) es de 32 ° F, y su punto de ebullición es de 212 ° F. La escala centígrada o Celsius, ideada por el astrónomo sueco Anders Celsius y utilizada en casi todo el mundo, asigna un valor de 0 ° C al punto de congelación del agua y de 100 ° C a su punto de fusión. En ciencia, la escala más empleada es la escala absoluta o Kelvin, inventada por el matemático y físico británico William Thomson, Lord Kelvin. En esta escala, el cero absoluto, que está situado en – 273,15 ° C, corresponde a 0 K, y una diferencia de un kelvin equivale a una diferencia de un grado en la escala centígrada.
La existencia de diferentes escalas termométricas hace necesario conocer las relaciones entre ellas:
![]() (1)
(1)
Donde:
º C: grados centígrados
º F: grados Fahrenheit
º R: grados Rankine
Para transformar grados centígrados a grados Fahrenheit se usa la siguiente expresión:
![]() (2)
(2)
Para transformar grados Fahrenheit a grados centígrados se usa la siguiente expresión:
![]() (3)
(3)
Para transformar grados centígrados a grados Kelvin se usa la siguiente expresión:
![]() (4)
(4)
Para transformar grados Fahrenheit a grados Rankine se usa la siguiente expresión:
![]() (5)
(5)
Para realizar conversiones que involucren incrementos de temperatura, se emplea:
1,8 º F = 1 º C (6)
1,8 R = 1 K (7)
1 º F = 1 R (8)
1 º C = 1 K (9)
1.3 Efecto de la temperatura sobre la materia.
La temperatura desempeña un papel importante para determinar las condiciones de supervivencia de los seres vivos. Así, las aves y los mamíferos necesitan un rango muy limitado de temperatura corporal para poder sobrevivir, y tienen que estar protegidos de temperaturas extremas.
Las especies acuáticas sólo pueden existir dentro de un estrecho rango de temperaturas del agua, diferente según las especies. Por ejemplo, un aumento de sólo unos grados en la temperatura de un río como resultado del calor desprendido por una central eléctrica puede provocar la contaminación del agua y matar a la mayoría de los peces originarios.
Los cambios de temperatura también afectan de forma importante a las propiedades de todos los materiales. A temperaturas árticas, por ejemplo, el acero se vuelve quebradizo y se rompe fácilmente, y los líquidos se solidifican o se hacen muy viscosos, ofreciendo una elevada resistencia por rozamiento al flujo. A temperaturas próximas al cero absoluto, muchos materiales presentan características sorprendentemente diferentes. A temperaturas elevadas, los materiales sólidos se licuan o se convierten en gases; los compuestos químicos se separan en sus componentes.
La temperatura de la atmósfera se ve muy influida tanto por las zonas de tierra como de mar. En enero, por ejemplo, las grandes masas de tierra del hemisferio norte están mucho más frías que los océanos de la misma latitud, y en julio la situación es la contraria. A bajas alturas, la temperatura del aire está determinada en gran medida por la temperatura de la superficie terrestre. Los cambios periódicos de temperatura se deben básicamente al calentamiento por la radiación del Sol de las zonas terrestres del planeta, que a su vez calientan el aire situado por encima. Como resultado de este fenómeno, la temperatura disminuye con la altura, desde un nivel de referencia de 15 ° C en el nivel del mar (en latitudes templadas) hasta unos – 55 ° C a 11.000 m aproximadamente. Por encima de esta altura, la temperatura permanece casi constante hasta unos 34.000 m.
Cuando una varilla metálica es sometida a calentamiento sufre una dilatación lineal, la cual puede cuantificarse a través de la siguiente expresión:
![]() (10)
(10)
Donde.
Lo: magnitud inicial de la varilla, m
Lf: magnitud final de la varilla, m
Tf: temperatura final de la varilla, º C
To: temperatura inicial de la varilla, º C
: coeficiente de expansión térmica lineal del material, º C -1
El coeficiente de expansión térmica lineal se expresa en 1/ºC ó 1/ºF dependiendo de las unidades usadas para expresar la temperatura. Cuando los metales se someten a enfriamiento progresivo sufren una contracción, por lo que la magnitud final será inferior a la magnitud inicial. La Tabla 1 resume el coeficiente de expansión térmica lineal de algunos materiales.
Tabla 1. Coeficientes de expansión de algunos materiales cerca de la temperatura ambiente.
| Material | Coeficiente de expansión lineal (º C –1) |
| Aluminio | 24 x 10-6 |
| Latón y bronce | 19 x 10-6 |
| Cobre | 17 x 10-6 |
| Vidrio (ordinario) | 9 x 10-6 |
| Vidrio (Pirex) | 3,2 x 10-6 |
| Plomo | 29 x 10-6 |
| Acero | 11 x 10-6 |
| Invar(aleación de Níquel – Cromo) | 6,9 x 10-6 |
| Concreto | 12 x 10-6 |
Las superficies metálicas al someterse a calentamiento se dilatan. El área final puede calcularse a través de la siguiente expresión:
![]() (11)
(11)
Donde:
Ao: área inicial de la superficie, m2
Af: área final de la superficie, m2
Tf: temperatura final de la superficie, º C
To: temperatura inicial de la superficie, º C
: coeficiente de expansión térmica lineal del material, º C -1
Se debe señalara que cuando las superficies metálicas son sometidas a enfriamiento sufren una contracción.
Los líquidos se dilatan al someterse a calentamiento (la mayoría), la expansión volumétrica de estos se puede calcular a través de la siguiente expresión:
![]() (12)
(12)
Donde:
Vo: volumen inicial del líquido, m3
Vf: volumen final del líquido, m3
Tf: temperatura final del líquido, º C
To: temperatura inicial del líquido, º C
: coeficiente de expansión térmica lineal del líquido o gas, º C -1
: coeficiente de expansión volumétrico del líquido o gas, º C -1
Nótese que:
![]() (13)
(13)
La Tabla 2 resume el coeficiente de expansión volumétrica de algunos líquidos y gases.
Tabla 2. Coeficientes de expansión volumétricos de algunos líquidos y gases.
| Material | Coeficiente de expansión volumétrico ( º C -1) |
| Alcohol etílico | 1,12 x 10-4 |
| Benceno | 1,12 x 10-4 |
| Acetona | 1,5 x 10-4 |
| Glicerina | 4,85 x 10-4 |
| Mercurio | 1,82 x 10-4 |
| Trementina | 9 x 10-4 |
| Gasolina | 9,6 x 10-4 |
| Aire a 0 º C | 3,67 x 10-4 |
| Helio a 0 º C | 3,665 x 10-4 |
Un caso especial de dilatación térmica lo constituye el fenómeno de barras empotradas. Las barras empotradas en paredes indeformables son sometidas a esfuerzos mecánicos como una consecuencia de la dilatación térmica inherente al material constitutivo de la misma. O sea, la dilatación térmica es contrarrestada por la expansión mecánica.
![]() desarrollando...
desarrollando...
![]() (14)
(14)
Donde:
Lo: magnitud de la barra empotrada a la temperatura inicial, m
Tf: temperatura final del sistema, º C
To: temperatura inicial del sistema, º C
P: fuerza de compresión generada en los apoyos, N/m2
E: módulo de elasticidad del material constitutivo de la barra, N/m2
A: área de la sección transversal de la barra, m2
: coeficiente de dilatación térmica lineal del material de la barra, º C -1
El esfuerzo mecánico al cual es sometida la barra se calcula, a través de la siguiente expresión:
![]() (15)
(15)
Donde:
P: fuerza de compresión generada en los apoyos, N/m2
A: área de la sección transversal de la barra, m2
: esfuerzo mecánico, N/m2
La Tabla 3 resume los módulos de elasticidad de algunos materiales.
Tabla 3. Valores comunes del módulo de elasticidad (conocido como módulo de Young).
| Sustancias | Módulo de Young (N/m2) |
| Aluminio | 7,0 x 1010 |
| Latón | 9,1 x 1010 |
| Cobre | 11 x 1010 |
| Acero | 20 x 1010 |
| Tungsteno | 35 x 1010 |
| Vidrio | 6,5 a 7,8 x 1010 |
| Cuarzo | 5,6 x 1010 |
Nota: el módulo de Young mide la resistencia de un sólido a un cambio en su magnitud.
1.5 Mecanismo de transferencia de calor
Los procesos físicos por los que se produce la transferencia de calor son la conducción y la radiación. Un tercer proceso, que también implica el movimiento de materia, se denomina convección. La conducción requiere contacto físico entre los cuerpos (o las partes de un cuerpo) que intercambian calor, pero en la radiación no hace falta que los cuerpos estén en contacto ni que haya materia entre ellos. La convección se produce a través del movimiento de un líquido o un gas en contacto con un cuerpo de temperatura diferente.
1.5.1 Mecanismo de transferencia de calor por conducción
El proceso de transferencia de energía térmica más sencillo de describir de manera cuantitativa recibe el nombre de conducción. En este proceso, la transferencia de energía térmica se puede ver a una escala atómica como un intercambio de energía cinética entre moléculas, donde las partículas menos energéticas ganan energía al chocar con las partículas más energéticas. A pesar de que la transferencia de energía térmica a través de un metal puede explicarse de modo parcial por las vibraciones atómicas y el movimiento de electrones, la tasa de conducción depende también de las propiedades de la trascendencia que es calentada.
La transferencia de calor por conducción es explicada satisfactoriamente por la Ley de Fourier:
![]() (16)
(16)
Donde:
q: velocidad de transferencia de calor por conducción, Cal/s
A: área transversal a la dirección de flujo de calor, m2
![]() : gradiente de temperatura en la sección de flujo de calor, º C/m
: gradiente de temperatura en la sección de flujo de calor, º C/m
k: conductividad térmica del material a través del medio por donde se transfiere el calor, Cal/s.m.º C
Cuando se desea calcular la velocidad de transferencia de calor por conducción a través de una placa o pared, se usa:
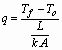 (17)
(17)
Donde:
q: velocidad de transferencia de calor por conducción, Cal/s
A: área transversal a la dirección de flujo de calor, m2
L: espesor de la placa, m
k: conductividad térmica del material a través del medio por donde se transfiere el calor, Cal/s.m.º C
Tf: temperatura de la superficie caliente, º C
To: temperatura de la superficie fría, º C
El término L/(k.A) se conoce con el nombre de resistencia térmica del material.
En el caso de transferencia de calor por conducción en tuberías se usa la siguiente expresión:
![]() (18)
(18)
Donde:
q: velocidad de transferencia de calor por conducción radial, Cal/s
ro: radio externo de la tubería, m
ri: radio interno de la tubería, m
L: largo del tubo, m
k: conductividad térmica del material a través del medio por donde se transfiere el calor, Cal/s.m.º C
Tf: temperatura de la superficie caliente, º C
To: temperatura de la superficie fría, º C
El término In(ro/ri)/(2..k.L) es conocido como resistencia térmica del material constitutivo del tubo.
La Tabla 4 resume las conductividades térmicas de algunas trascendencias.
Tabla 4. Conductividades térmicas de algunas trascendencias.
| Sustancia | Conductividad térmica (W/m ºC) |
| Metales (a 25 ºC) | |
| Aluminio | 238 |
| Cobre | 397 |
| Oro | 314 |
| Hierro | 79,5 |
| Plomo | 34,7 |
| Plata | 427 |
| Gases (a 25 ºC) | |
| Aire | 0,0234 |
| Helio | 0,138 |
| Hidrógeno | 0,172 |
| Nitrógeno | 0,0234 |
| Oxígeno | 0,0238 |
| No metales (valores aproximados) | |
| Asbestos | 0,08 |
| Concreto | 0,8 |
| Diamante | 2.300 |
| Vidrio | 0,8 |
| Hielo | 2 |
| Hule | 0,2 |
| Agua | 0,6 |
| Madera | 0,08 |
Por lo general, se suelen encontrar paredes compuestas por diferentes materiales o tubos recubiertos con una variedad de aislantes, en estos casos se suman las resistencias térmicas dependiendo de su configuración.
Si las resistencias térmicas se encuentran en serie:
![]() (19)
(19)
Si las resistencias están dispuestas en paralelo:
 (20)
(20)
1.5.2 Mecanismo de transferencia de calor por convección
Es probable que usted alguna vez haya calentado sus manos sometiéndolas sobre una flama descubierta. En esta situación, el aire directamente encima de la flama se caliente y expande. Como resultado, la densidad del aire disminuye y éste asciende. Esta masa de aire caliente le da calor a sus manos cuando fluye por ellas.
Se afirma que la energía térmica transferida por el movimiento de la trascendencia calentada se ha transferido por convección. Cuando el movimiento se produce por diferencia en la densidad, como en el ejemplo del aire alrededor del fuego, esta se conoce como convección natural. Cuando la trascendencia calentada es obligada a moverse mediante un ventilador o bomba, como en algunos sistemas de calefacción de aire caliente y agua caliente, el proceso se denomina convección forzada.
La velocidad de transferencia de calor por convección se calcula a través de la siguiente expresión:
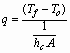 (21)
(21)
Donde:
q: velocidad de transferencia de calor por convección, Cal/s
A: área transversal a la dirección de flujo de calor, m2
hc: coeficiente convectivo de transferencia de calor del medio, Cal/s.m2.º C
Tf: temperatura de la zona caliente, º C
To: temperatura de la zona fría, º C
1.5.3 Mecanismo de transferencia de calor por radiación
La tercera forma de transferencia de energía térmica es denominada radiación. Todos los objetos radian energía continuamente en forma de ondas electromagnéticas. El tipo de radiación asociado a la transferencia de energía térmica de un local a otro se conoce como radiación infrarroja.
La tasa a la cual un objeto emite energía radiante es proporcional a la cuarta potencia de su temperatura absoluta. Esto se conoce como la Ley de Stefan y se expresa en forma de ecuación como:
![]() (22)
(22)
Donde:
P: potencia radiada por el cuerpo, watt
: constante igual a 5.6696 x 10-8 W/m2.K4
A: área superficial del objeto, m2
e: emisividad del cuerpo, adimensional
T: temperatura del cuerpo, K
La emisividad depende de la naturaleza de la superficie del objeto, pudiendo variar de 0 a 1. Si se desea cuantificar la velocidad de transferencia de calor por radiación entre dos objetos, se usará:
![]() (23)
(23)
Donde:
q: velocidad de transferencia de calor por radiación, Btu/h
: constante de Stefan – Boltzman igual a 0,1714 x 10-8 Btu/Hr.Ft2.R4
Fe: factor de emisividad, adimensional
: factor de forma
Th: temperatura de la zona caliente, R
Tc: temperatura de la zona fría, R
A: área a través de la cual se da la transferencia de calor, Ft2
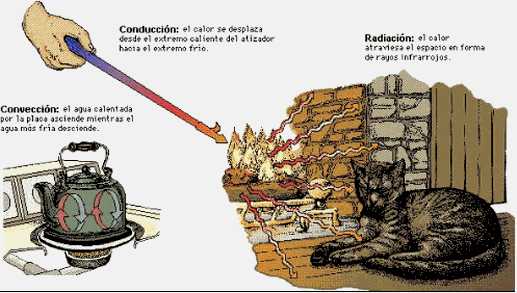
Figura 1. El calor puede transferirse de tres formas: por conducción, por convección y por radiación. La conducción es la transferencia de calor a través de un objeto sólido: es lo que hace que el asa de un atizador se caliente aunque sólo la punta esté en el fuego. La convección transfiere calor por el intercambio de moléculas frías y calientes: es la causa de que el agua de una tetera se caliente uniformemente aunque sólo su parte inferior esté en contacto con la llama. La radiación es la transferencia de calor por radiación electromagnética (generalmente infrarroja): es el principal mecanismo por el que un fuego calienta la habitación.
1.6 Calor latente y calor sensible
El cambio de temperatura de una trascendencia conlleva una serie de cambios físicos. Casi todas las trascendencias aumentan de volumen al calentarse y se contraen al enfriarse. El comportamiento del agua entre 0 y 4 ° C constituye una importante excepción a esta regla. Se denomina fase de una trascendencia a su estado, que puede ser sólido, líquido o gaseoso. Los cambios de fase en trascendencias puras tienen local a temperaturas y presiones definidas.
El paso de sólido a gas se denomina sublimación, de sólido a líquido fusión, y de líquido a vapor vaporización. Si la presión es constante, estos procesos tienen local a una temperatura constante. La cantidad de calor necesaria para producir un cambio de fase se llama calor latente; existen calores latentes de sublimación, fusión y vaporización.
Si se hierve agua en un recipiente abierto a la presión de 1 atmósfera, la temperatura no aumenta por encima de los 100 °C por mucho calor que se suministre. El calor que se absorbe sin cambiar la temperatura del agua es el calor latente; no se pierde, sino que se emplea en transformar el agua en vapor y se almacena como energía en el vapor.
Cuando el vapor se condensa para formar agua, esta energía vuelve a liberarse. Del mismo modo, si se calienta una mezcla de hielo y agua, su temperatura no cambia hasta que se funde todo el hielo. El calor latente absorbido se emplea para vencer las fuerzas que mantienen unidas las partículas de hielo, y se almacena como energía en el agua. Para fundir 1 kg de hielo se necesitan 19.000 julios, y para convertir 1 kg de agua en vapor a 100 °C, hacen falta 129.000 julios.
1.6.1 Calor de vaporización
Es la cantidad de calor que es suministrado a una trascendencia para llevarlo de estado líquido a estado gaseoso sin incremento de temperatura. Se calcula a través de la siguiente expresión:
![]() (24)
(24)
Donde:
Q: calor de evaporación, Cal
m: masa de la trascendencia que se evapora, Kg
e: calor de evaporación de la trascendencia, Cal/Kg
1.6.2 Calor de fusión
Es la cantidad de calor que es suministrado a una trascendencia para llevarla de estado sólido al líquido sin incrementar su temperatura. Se calcula a través de la siguiente expresión:
![]() (25)
(25)
Donde:
Q: calor de fusión, Cal
m: masa de la trascendencia que se fusiona, Kg
f: calor de fusión de la trascendencia, Cal/Kg
1.6.3 Calor de combustión
Es la cantidad de calor desprendida en la combustión completa de un mol de trascendencia.
La Tabla 5 resume los calores de fusión y evaporación de algunas trascendencias. La Tabla 6 muestra los calores particulars de algunas trascendencias a 25 º C y a presión atmosférica.
1.7 Energía específica transferida por una trascendencia: calor particular
La cantidad de calor necesaria para aumentar en un grado la temperatura de una unidad de masa de una trascendencia se conoce como calor particular. Si el calentamiento se produce manteniendo constante el volumen de la trascendencia o su presión, se habla de calor particular a volumen constante o a presión constante.
En todas las trascendencias, el primero siempre es menor o igual que el segundo. El calor particular del agua a 15 ° C es de 4.185,5 julios por kilogramo y grado Celsius. En el caso del agua y de otras trascendencias prácticamente incompresibles, no es necesario distinguir entre los calores particulars a volumen constante y presión constante ya que son aproximadamente iguales. Generalmente, los dos calores particulars de una trascendencia dependen de la temperatura.
La energía térmica transferida entre una trascendencia de masa m y sus alrededores para un cambio de temperatura ![]() T esta dado por:
T esta dado por:
![]() (26)
(26)
Donde:
Q: cantidad de calor transferida, Cal
Ce: calor particular de la trascendencia, Cal/Kg. ºC
![]() T: cambio de temperatura experimentado por la trascendencia, º C
T: cambio de temperatura experimentado por la trascendencia, º C
Tabla 5. Calores latentes de fusión y evaporación de algunas trascendencias.
| Sustancia | Punto de fusión (ºC) | Calor latente de fusión (J/Kg) | Punto de ebullición (ºC) | Calor latente de vaporización (J/Kg) |
| Helio | -269,65 | 5,23 x 103 | -268,93 | 2,09 x 104 |
| Nitrógeno | -209,97 | 2,55 x 104 | -195,81 | 2,01 x 105 |
| Alcohol etílico | -114 | 1,04 x 105 | 78 | 8,54 x 105 |
| Agua | 0 | 3,33 x 105 | 100 | 2,26 x 106 |
| Azufre | 119 | 3,81 x 104 | 444,60 | 3,26 x 105 |
| Plomo | 327,3 | 2,45 x 104 | 1750 | 8,70 x 105 |
| Aluminio | 660 | 3,97 x 105 | 2450 | 1,14 x 107 |
| Plata | 960,80 | 8,82 x 104 | 2193 | 2,33 x 106 |
| Oro | 1063,00 | 6,44 x 104 | 2660 | 1,58 x 106 |
| Cobre | 1083 | 1,34 x 105 | 1187 | 5,06 x 106 |
Tabla 6. Calores particulars de algunas trascendencias a 25 ºC y a presión atmosférica.
| Sustancia | Calor particular (cal/g.ºC) |
| Aluminio | 0,215 |
| Berilio | 0,436 |
| Cadmio | 0,055 |
| Cobre | 0,0924 |
| Germanio | 0,077 |
| Oro | 0,0308 |
| Hierro | 0,107 |
| Plomo | 0,0305 |
| Silicio | 0,168 |
| Plata | 0,056 |
| Otros sólidos | |
| Latón | 0,092 |
| Madera | 0,41 |
| Vidrio | 0,200 |
| Hielo (- 5 º C) | 0,50 |
| Mármol | 0,21 |
| Líquidos | |
| Alcohol etílico | 0,58 |
| Mercurio | 0,033 |
| Agua (15 º C) | 1 |
1.8 Leyes fundamentales de la termodinámica
1.8.1 Ley cero de la termodinámica
Frecuentemente, el vocabulario de las ciencias empíricas se toma prestado del lenguaje de la vida diaria. Así, aunque el término de temperatura parece evidente para el sentido común, su significado adolece de la imprecisión del lenguaje no matemático. El llamado principio cero de la termodinámica que se explica a continuación proporciona una definición precisa, aunque empírica, de la temperatura.
Cuando dos sistemas están en equilibrio mutuo, comparten una determinada propiedad. Esta propiedad puede medirse, y se le puede asignar un valor numérico definido. Una consecuencia de ese hecho es el principio cero de la termodinámica, que afirma que si dos sistemas distintos están en equilibrio termodinámico con un tercero, también tienen que estar en equilibrio entre sí. Esta propiedad compartida en el equilibrio es la temperatura.
Si uno de estos sistemas se pone en contacto con un entorno infinito situado a una determinada temperatura, el sistema acabará alcanzando el equilibrio termodinámico con su entorno, es decir, llegará a tener la misma temperatura que éste. (El llamado entorno infinito es una abstracción matemática denominada depósito térmico; en realidad basta con que el entorno sea grande en relación con el sistema estudiado).
La temperatura se mide con dispositivos llamados termómetros. Un termómetro contiene una trascendencia con estados fácilmente identificables y reproducibles, por ejemplo el agua pura y sus puntos de ebullición y congelación normales. Si se traza una escala graduada entre dos de estos estados, la temperatura de cualquier sistema puede determinarse poniéndolo en contacto térmico con el termómetro, siempre que el sistema sea grande en relación con el termómetro.
1.8.2 Primera ley de la termodinámica
La primera ley de la termodinámica da una definición precisa del calor, otro concepto de uso corriente.
Cuando un sistema se pone en contacto con otro más frío que él, tiene local un proceso de igualación de las temperaturas de ambos. Para explicar este fenómeno, los científicos del siglo XVIII conjeturaron que una trascendencia que estaba presente en mayor cantidad en el cuerpo de mayor temperatura fluía hacia el cuerpo de menor temperatura. Según se creía, esta trascendencia hipotética llamada calórico era un fluido capaz de atravesar los medios materiales. Por el contrario, el primer principio de la termodinámica identifica el calórico, o calor, como una forma de energía. Puede convertirse en trabajo mecánico y almacenarse, pero no es una trascendencia material. Experimentalmente se demostró que el calor, que originalmente se medía en unidades llamadas calorías, y el trabajo o energía, medidos en julios, eran completamente equivalentes. Una caloría equivale a 4,186 julios.
El primer principio es una ley de conservación de la energía. Afirma que, como la energía no puede crearse ni destruirse (dejando a un lado las posteriores ramificaciones de la equivalencia entre masa y energía) la cantidad de energía transferida a un sistema en forma de calor más la cantidad de energía transferida en forma de trabajo sobre el sistema debe ser igual al aumento de la energía interna del sistema. El calor y el trabajo son mecanismos por los que los sistemas intercambian energía entre sí.
En toda transformación entre calor y trabajo la cantidad de calor entregada a un sistema, es igual al trabajo realizado por el sistema, más la variación de su energía interna.
![]() (27)
(27)
Donde:
Q: cantidad de calor transferido, Cal
W: trabajo realizado por el sistema, Cal
![]() U: variación de la energía sistema del sistema, Cal
U: variación de la energía sistema del sistema, Cal
Consideraciones:
- El calor se considera positivo si entra en el sistema.
- El calor se considera negativo si sale del sistema.
- El trabajo se considera positivo si el sistema realiza trabajo sobre el exterior.
- El trabajo se considera negativo si el exterior realiza trabajo sobre el sistema.
El trabajo desarrollado por un gas esta dado por:
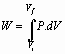 (28)
(28)
Donde:
W: trabajo efectuado por fluido, Joule
P: presión del gas, N/m2
dV: diferencial de volumen, m3
1.9 Procesos térmicos en gases ideales
La teoría atómica de la materia define los estados, o fases, de acuerdo al orden que implican. Las moléculas tienen una cierta libertad de movimientos en el espacio. Estos grados de libertad microscópicos están asociados con el concepto de orden macroscópico. Las moléculas de un sólido están colocadas en una red, y su libertad está restringida a pequeñas vibraciones en torno a los puntos de esa red. En cambio, un gas no tiene un orden espacial macroscópico. Sus moléculas se mueven aleatoriamente, y sólo están limitadas por las paredes del recipiente que lo contiene.
Se han desarrollado leyes empíricas que relacionan las variables macroscópicas. En los gases ideales, estas variables incluyen la presión (p), el volumen (V) y la temperatura (T). La Ley de Boyle-Mariotte afirma que el volumen de un gas a temperatura constante es inversamente proporcional a la presión (Proceso Isotérmico). La Ley de Charles y Gay-Lussac afirma que el volumen de un gas a presión constante es directamente proporcional a la temperatura absoluta (Proceso Isobárico). La combinación de estas dos leyes proporciona la Ley de los Gases Ideales pV = nRT (n es el número de moles), también llamada Ecuación de Estado del Gas Ideal. La constante de la derecha, R, es una constante universal cuyo descubrimiento fue una piedra angular de la ciencia moderna. En consecuencia, si una masa dada de gas se considera en dos condiciones de presión y temperatura distintas, se verifica:
![]() (29)
(29)
Ahora bien, como para una masa dada de gas, la densidad es inversamente proporcional al volumen, la ecuación anterior puede escribirse en la forma:
![]() (30)
(30)
Para un mol de gas la Ley General de los Gases también se puede escribir en la forma:
p.V = R.T (31)
en donde R es la constante universal de los gases que es igual para todos ellos siempre que lo que se considere sea un mol. Si existen n moles,
p.V = n.R.T (32)
Para hallar el valor R se razona así:
Un mol cualquiera de gas ocupa en condiciones normales de presión y temperatura, un volumen de 22.4 litros, por ende:
![]() = 0.0821 Lts.atm/mol.K (33)
= 0.0821 Lts.atm/mol.K (33)
La constante universal(o molar) de los gases posee las siguientes equivalencias: 8.314,34 Joule/Kgmol.K = 1,986 Kcal/Kgmol.K = 1.545 Lbf.pie/Lbmol.R =1,986 BTU/Lbmol.R
1.9.1 Procesos isobáricos
Cuando una masa m de un gas se calienta, manteniendo constante la presión P, se verifica:
![]() (34)
(34)
Donde:
Q: calor transferido, Cal
Cp: calor particular del gas a presión constante, Cal/kg.ºC
Tf: temperatura terminal del gas, º C
To: temperatura inicial del gas, º C
m: masa del gas, Kg
![]() (35)
(35)
Donde:
![]() U: variación de la energía interna, Cal
U: variación de la energía interna, Cal
m: masa del gas, Kg
Cv: calor particular del gas a volumen constante, Cal/kg.ºC
Tf: temperatura terminal del gas, º C
To: temperatura inicial del gas, º C
![]() (36)
(36)
Donde:
P: presión del sistema, N/m2
Vf: temperatura terminal del gas, m3
Vo: temperatura inicial del gas, m3
1.9.2 Procesos isocóricos
Cuando una masa m de un gas se calienta, manteniendo constante el volumen V, se verifica:
W = 0 (no se ejecuta trabajo, por no haber variación del volumen del gas).
![]() (37)
(37)
Donde:
Q: calor transferido, Cal
![]() U: variación de la energía interna, Cal
U: variación de la energía interna, Cal
m: masa del gas, Kg
Cv: calor particular del gas a volumen constante, Cal/Kg.ºC
Tf: temperatura terminal del gas, º C
To: temperatura inicial del gas, º C
1.9.3 Procesos isotérmicos
Cuando una masa m de gas se dilata isotérmicamente en contra de una presión exterior, la variación de la energía interna es nula, con lo que el calor que se suministra al sistema es igual al trabajo que realiza el gas. En estas condiciones se verifica la Ley de Boyle:
![]() (38)
(38)
Donde:
Q: calor transferido, Cal
P1: presión del gas al inicio del proceso, N/m2
V1: volumen del gas al inicio del proceso, m3
W: trabajo efectuado por el gas, Joule = N.m
Vf: volumen final del gas, m3
Vo: volumen inicial del gas, m3
1.9.4 Procesos adiabáticos
Un proceso adiabático en termodinámica, es cualquier proceso físico en el que magnitudes como la presión o el volumen se modifican sin una transferencia significativa de energía calorífica hacia el entorno o desde éste. Un ejemplo corriente es la emisión de aerosol por un pulverizador, acompañada de una disminución de la temperatura del pulverizador. La expansión de los gases consume energía, que procede del calor del líquido del pulverizador. El proceso tiene local demasiado rápido como para que el calor perdido sea reemplazado desde el entorno, por lo que la temperatura desciende. El efecto inverso, un aumento de temperatura, se observa cuando un gas se comprime rápidamente. Muchos sistemas comunes, como los motores de automóvil, presentan fenómenos adiabáticos. Es aquella en la que no existe ninguna transferencia de calor entre el sistema con el medio exterior. Por consiguiente, en todo proceso adiabático se verifica:
Q = 0 (39)
W = - ![]() U (40)
U (40)
De igual manera se cumple:
![]() (41)
(41)
Donde:
P: presión del gas, N/m2
V: volumen del gas, m3
![]() : coeficiente adiabático del gas, adimensional
: coeficiente adiabático del gas, adimensional
El coeficiente adiabático del gas se calcula:
![]() (42)
(42)
Donde:
![]() : coeficiente adiabático del gas, adimensional
: coeficiente adiabático del gas, adimensional
Cp: calor particular del gas a presión constante, Cal/Kg.ºC
Cv: calor particular del gas a volumen constante, Cal/Kg.ºC
El trabajo realizado por un gas en un proceso adiabático se cuantifica a través de siguiente expresión:
![]() (43)
(43)
Donde:
P2, P1: presión final e inicial del gas respectivamente, N/m2
V2, V1: volumen final e inicial respectivamente, m3
![]() : coeficiente adiabático del gas, adimensional
: coeficiente adiabático del gas, adimensional
W: trabajo desarrollado por el gas, Joule = N.m
PROBLEMAS PROPUESTOS CON RESPUESTAS
A.- Dilatación de Sólidos y Líquidos
1. Una barra de cobre mide 8 m a 15 ºC. Hallar la variación que experimenta su magnitud al calentarla hasta 35 ºC. El coeficiente de dilatación térmica del cobre vale 17 x 10-6 ºC-1
Sol. 0,00272 cm
2. Un eje de acero tiene un diámetro de 10 cm a 30 ºC. Calcular la temperatura que deberá existir para que encaje perfectamente en un agujero de 9,997 cm de diámetro. El coeficiente de dilatación lineal del acero vale 11 x 10-6 ºC-1
Sol. 2,727 º C
3. Un bulbo de vidrio está de bote en bote con 50 cm3 de argento vivo a 18 ºC. Calcular el volumen (medido a 38 ºC) que sale del bulbo si se eleva su temperatura hasta 38 ºC. El coeficiente de dilatación lineal del vidrio es 9 x 10-6 ºC-1, y el correspondiente coeficiente cúbico del argento vivo vale 18 x 10-5 ºC-1
Sol. 0.153 cm3
4. La densidad del argento vivo a 0 ºC es 13,6 g/cm3, y el coeficiente de dilatación cúbica, 1,82 x 10-4 ºC-1. Hállese la densidad del argento vivo a 50 ºC
Sol. 13,477 g/cm3
5. El coeficiente de dilatación lineal del vidrio vale 9 x 10-4 ºC. ¿Qué capacidad tendrá un frasco de vidrio a 25 ºC, si su valor a 15 ºC es de 50 cm3?
Sol. 51,35 cm3
6. Una vasija de vidrio esta llena de ciertamente con 1 l de terpentina a 50 ºF. Hallar el volumen de líquido que se derrama si se calienta hasta 86 ºF. El coeficiente de dilatación lineal del vidrio vale 9 x 10-6 ºC y el de dilatación cúbica de terpentina es 97 x 10-5 ºC-1
Sol. 33.948 cm3
7. ¿A qué temperatura las lecturas de dos termómetros, uno de ellos graduados en escala centígrada y el otro en Fahrenheit, indican la misma lectura?
Sol. 40 ºF
8. Una acera de concreto se vacía un día en que la temperatura es 20 ºC de modo tal que los extremos no tienen posibilidad de moverse. A) ¿Cuál es el esfuerzo en el cemento en un día caluroso a 50 ºC?, B) ¿Se fractura el concreto?. Considere el módulo de Young para el concreto igual a 7 x 109 N/m2 y la resistencia a la tensión como 2 x 109 N/m2. Coeficiente de expansión lineal del concreto 12 x 10-6 ºC-1
Sol. =2,52 x 10-6 N/m2; No sufre rotura
9. A 20 ºC, un anillo de aluminio tiene un diámetro interior de 5 cm, y una barra de latón tiene un diámetro de 5,050 cm. A) ¿Hasta que temperatura debe calentarse el anillo de modo que se deslice apenas sobre la barra?, B) ¿A qué temperatura deben calentarse ambos de manera que el anillo apenas se deslice sobre la barra?, C) ¿El último proceso funcionará?. Coeficiente de expansión lineal del aluminio 24 x 10-6 ºC-1; Coeficiente de expansión lineal del latón 19 x 10-6 ºC-1
Sol. 436,7 ºC; 2.099 ºC; los materiales se vaporizarían
10. El elemento activo de cierto láser esta hecho de una barra de vidrio de 30 cm de largo por 1,5 cm de diámetro. Si la temperatura de la barra aumenta en 65 ºC, encuentre el aumento en a) magnitud, b) su diámetro, c) su volumen. Coeficiente de dilatación lineal del vidrio 9 x 10-4 ºC-1
Sol. L = 1,755 cm; D = 0,08775 cm; V = 9,304 cm3
11. El puente de New River George en Virginia Occidental es un arco de acero de 518 m de largo. ¿Cuánto cambia esta magnitud entre temperaturas extremas de – 20 ºC a 50 ºC?
Sol. 0,39886 m
12. Un alambre telefónico de cobre
